
PRISE EN COMPTE DU STRESS OXYDATIF LORS D’ATTEINTE HÉPATIQUE CHEZ LE CHIEN ET LE CHAT
Les atteintes hépatiques sont des causes fréquentes de consultation chez nos carnivores domestiques. Bien que la pose du diagnostic soit difficile tant les étiologies sont diverses (infections virales, bactériennes ou parasitaires; intoxications; néoplasie; atteinte génétique etc) toutes ces affections se rejoignent au niveau de la physiopathologie : une atteinte hépatique implique un stress oxydatif et une inflammation.
Dans ce dossier en trois parties complémentaires nous allons expliquer le phénomène du stress oxydatif qui a lieu lors d’atteinte hépatique, puis nous verrons comment prendre en compte ce phénomène pour favoriser la protection du foie.
Rappels sur le stress oxydatif et les espèces réactives de l’oxygène
Pour commencer, nous allons nous intéresser aux Espèces Réactives de l’Oxygène (appelées EROs dans la suite de ce dossier), dont la connaissance est nécessaire pour bien comprendre ce qu’est le stress oxydatif.
Définitions
Le stress oxydatif correspond à une agression des constituants cellulaires. Il a lieu lorsque des radicaux libres sont présents en excès par rapport aux antioxydants de l’organisme. Les radicaux libres sont des espèces qui possèdent au moins un électron non apparié et qui sont de ce fait très réactifs. En effet, ils cherchent à devenir stables et pour ce faire, ils doivent récupérer des électrons d’autres molécules en les oxydant (oxyder = « arracher des électrons »). Cela provoque alors la production d’autres radicaux libres : c’est la cascade radiculaire. Les systèmes antioxydants de l’organisme sont alors dépassés et un déséquilibre s’installe.
L’expression « EROs » rassemble les radicaux libres de l’oxygène et des molécules non radiculaires susceptibles de produire des radicaux libres. La majeure partie des EROs est issue du métabolisme cellulaire et est donc physiologique (les mitochondries sont les sources principales d’EROs endogènes via la respiration cellulaire). Cependant, il existe aussi une production exogène d’EROs à la suite de réactions avec les UV, les polluants aériens et aquatiques, les métaux lourds, les pesticides, les médicaments etc.
Trois EROs ont une importance majeure : le radical hydroxyle (le plus dangereux) ainsi que l’anion superoxyde et le peroxyde d’hydrogène (ces deux derniers permettant de produire le radical hydroxyle).
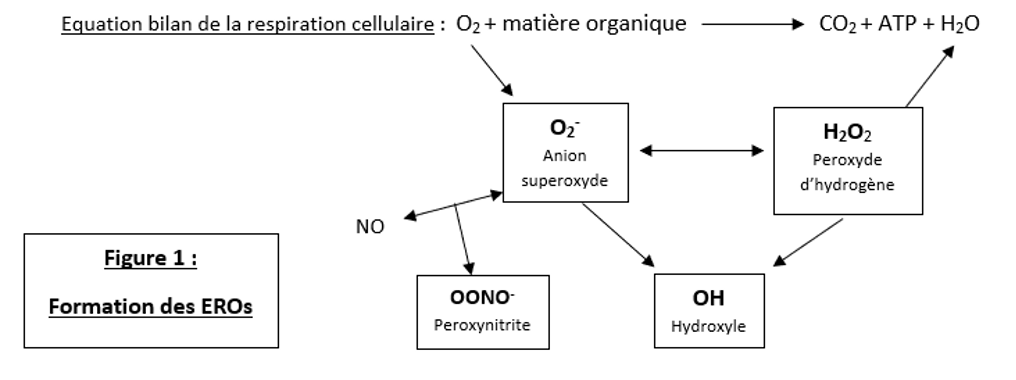
Formation des EROs
Toutes les cellules aérobies de l’organisme réalisent la respiration cellulaire, qui a lieu dans les mitochondries. Au cours de cette réaction, la matière organique comme le glucose est oxydée par des enzymes afin de former des molécules d’ATP, forme d’énergie directement utilisable par la cellule. Comme dans toute réaction d’oxydo-réduction, il faut un accepteur d’électrons : ici le dioxygène. L’O2 est ainsi réduit en anion superoxyde (à son tour réduit en peroxyde d’hydrogène, lui-même réduit en eau).
Caractéristiques de l’anion superoxyde O2– :
- ERO la plus largement disséminée dans les tissus
- Temps de demie vie t1/2 mille fois plus long que celui du radical hydroxyle
- Réactivité relativement faible
- Autres voies de synthèse : catabolisme des bases puriques, métabolisme des xénobiotiques…
L’anion superoxyde est ensuite réduit en peroxyde d’hydrogène par l’enzyme superoxyde dismutase (SOD).
Caractéristiques du peroxyde d’hydrogène H2O2 :
- Réactivité faible
- Bonne pénétration dans les membranes biologiques.
Le peroxyde d’hydrogène est normalement réduit en eau par l’enzyme GSH peroxydase (GSHPx), présente dans de nombreuses cellules et fonctionnant en présence de glutathion : in fine on a donc bien l’O2 qui est réduit en eau H2O. Cependant, il existe une « fuite d’électrons » de cette chaîne respiratoire : environ 1 à 4% de l’O2 initial échappe à la réduction en eau. Cela forme d’autres EROs comme les radicaux hydroxyle, alkyle, peroxyle ou encore des peroxynitrites. On peut prendre l’exemple de la réaction de Fenton, une autre voie de dégradation du peroxyde d’hydrogène, qui a lieu en présence de métaux intermédiaires sous forme réduite, comme le Fe2+, et qui aboutit à la formation du radical hydroxyle.
Caractéristiques du radical hydroxyle OH :
- Radical libre le plus dangereux car extrêmement réactif avec toutes sortes de molécules
- t1/2 de l’ordre du nanoseconde (normalement neutralisé presque instantanément par le glutathion)
- Autres voies de synthèse : photolyse du peroxyde d’hydrogène par les UV ou radiolyse de l’eau par les radiations ionisantes.
Article rédigé par :
Romain LAPLACE
ProVeto Junior Conseil


