Il est assez rare en pathobiologie de découvrir des phénomènes nouveaux ayant une importance clinique et thérapeutique importante.
Des efforts importants ont été déployés pour comprendre quels sont les mécanismes moléculaires de l’inflammation et comment lutter contre cette dernière. En effet, une inflammation de trop longue durée ou trop intense pourrait avoir des effets délétères sur l’organe où elle siège et potentiellement entraver sa fonction. La phase d’initiation de l’inflammation est maintenant bien comprise. En revanche, la phase tardive de l’inflammation était jusque récemment mal définie. Les travaux d’une équipe de l’Ecole de Médecine de Harvard sous la direction du professeur Charles Serhan ont permis de comprendre ces dernières années cette phase appelée résolution ou catabase caractérisée par le retour à l’homéostase du tissu enflammé.
1- RAPPEL SUR L’ INFLAMMATION
L’inflammation est un phénomène immunologique d’importance vitale. Il s’agit souvent de la première ligne de défense de l’organisme contre une agression externe ou un stimulus d’origine interne. Elle est définie comme une réponse protectrice localisée d’un tissu vascularisé à une lésion de type mécanique (traumatisme, point de suture, corps étranger, altération du cartilage…) biologique (infection, antigène…) ou chimique (produit corrosif….).
L’inflammation est caractérisée par les signes cliniques suivants : rougeur et chaleur (liés à l’augmentation du flot sanguin), l’enflure (liée à l’exudation et oedème des tissus) et la douleur (liée à des médiateurs chimiques et à la compression des terminaisons nerveuses). En plus nous observons très souvent une perte de fonction liée à l’oedème, à la douleur et à des dommages tissulaires.
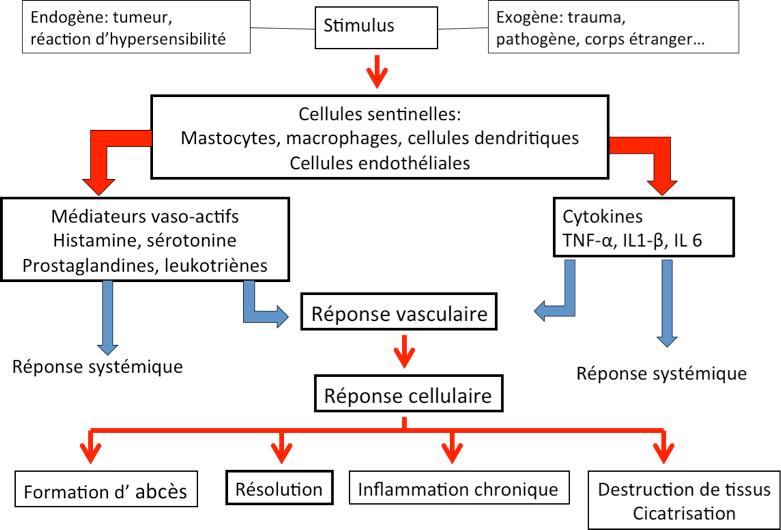
L’inflammation démarre toujours par un stimulus endogène ou exogène qui agit au niveau de cellules sentinelles du système immunitaires ( mastocytes, macrophages, cellule dendritiques) ou de cellules endothéliales (paroi des capillaires) pour stimuler la production de médiateurs chimiques qui joue un rôle capital dans le déroulement de l’inflammation (figure 1).. Ces médiateurs peuvent être des cytokines comme le TNF alpha ou les interleukines 1 et 6 ou de médiateurs vaso -actifs comme l’histamine, libérée rapidement par dégranulation des mastocytes, ou des dérivés d’acides gras insaturés oméga 6 et de l’acide arachidonique, les prostaglandines et les leukotriènes. Sous l’influence de ces médiateurs une réponse vasculaire locale se met en place rapidement avec une augmentation du flot sanguin suivie d’ une dilatation et d’une augmentation de la perméabilité des capillaires résultant en une exudation de plasma et de protéines (enzymes, compléments) dans les tissus environnants. La réponse cellulaire qui suit commence par une marginalisation des neutrophiles à l’intérieur des capillaires suivi de leur migrations dans les tissus environnants par diapédèse à travers la paroi des vaisseaux. Le rôle des neutrophiles est de détruire la cause de l’inflammation par phagocytose. Mais les neutrophiles sont souvent hyperactivés et relâchent dans les tissus des enzymes lytiques et des radicaux oxygénés qui contribuent à la pathologie inflammatoire.
Figure 1: L’inflammation en résumé
Il existe 4 issues possible pour l’inflammation: la formation d’abcès en cas d’infection, le passage à un état chronique, une cicatrisation avec formation de tissu fibreux suite à une destruction de tissu et le retour à la normale ou résolution. De ces 4 possibilités seule la résolution est acceptable par l’organisme.
2- LA RÉSOLUTION DE L’ INFLAMMATION
2.1 Description
Pour un retour à l’homéostase il faut qu’un certain nombre de conditions soient remplies:
- Destruction de la cause de l’inflammation
- Neutralisation, destruction des médiateurs chimiques
- Retour au flot sanguin et à la perméabilité capillaire normale
- Cessation de la migration des leukocytes
- Apoptose, mort cellulaire des neutrophiles et leur phagocytose par les macrophages
- Disposition de l’exudat, de la fibrine par phagocytose par les macrophages et drainage par le système lymphatique
- Régénération des tissus
L’ensemble des processus qui permettent de remplir ces conditions constituent la résolution de l’inflammation.
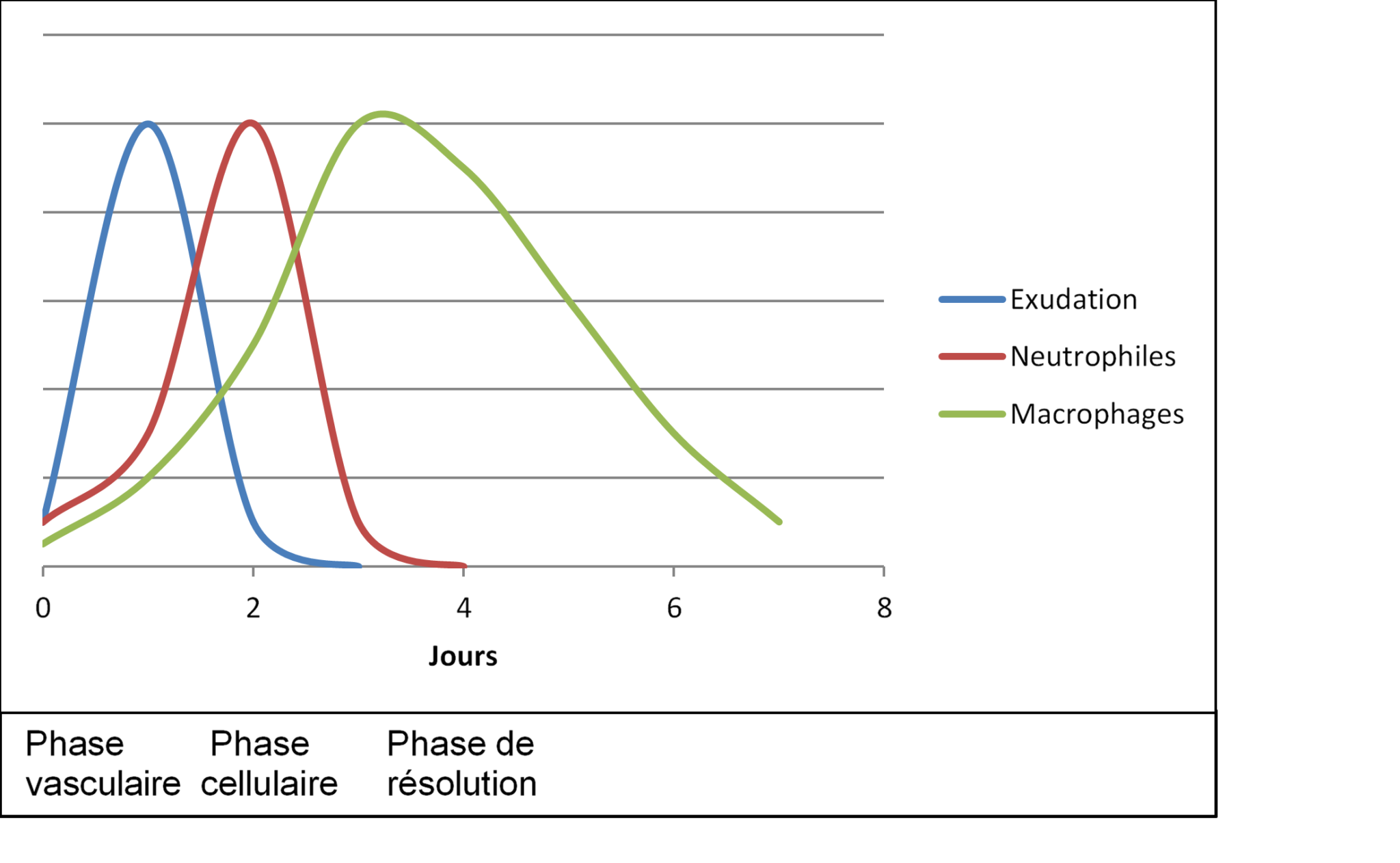
Figure 2: Les différentes phases de l’inflammation dans le temps.
Pendant longtemps nous avons cru que la fin de l’inflammation était un phénomène passif sans contrôle réel. En fait nous savons maintenant qu’il s’agit au contraire d’un processus très actif sous la dépendance de médiateurs lipidiques dérives des acides gras insaturés.
2.2 Les médiateurs de la résolution
a- Rôle
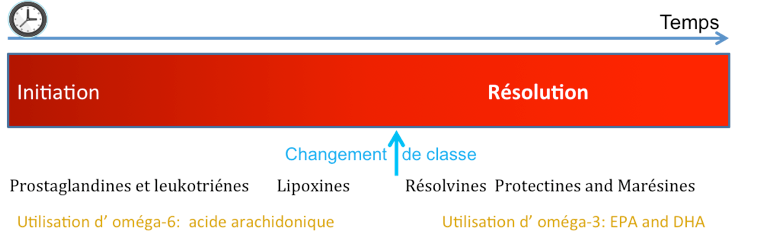
Le rôle des prostaglandines et leukotriènes dérivés de l’acide arachidonique et donc des acides gras insaturés oméga 6 dans l’initiation de l’inflammation est bien connu de même que l’ utilisation des anti-inflammatoires non stéroidiens (AINS) et des corticostéroides pour bloquer leur formation. Mais la présence de certaines prostaglandines ( PGE2 et PGD 2 ) est en fait paradoxalement nécéssaire pour l’initiation de la résolution de l’inflammation. La nouvelle famille de médiateurs lipidiques identifiés récemment dans la phase de résolution est composée des lipoxines, résolvines de séries E ou D, protectines et marésines.
Leur rôle est maintenant établi ( Serhan 2008):
- Arrêt de la migration des neutrophiles
- Retour de la perméabilité des capillaires à la normale
- Stimulation du recrutement des macrophages
- Stimulation de la phagocytose des neutrophiles par les macrophages
- Inhibition le TNF-α et l’IL-12
- Facilitation de l’élimination des chémokines
- Blocage des signaux impliqués dans la douleur
- Freinage de la formation de tissus fibreux
- Inhibition de la formation d’anion superoxide
Ce rôle a été confirmé en clinique humaine dans de nombreux modèles animaux de colite, péritonite, néphrite, dermatite, asthme, ischémie, rétinopathie, gengivite, pleurite, oedème et choc endotoxinique (Serhan et al 2008).
b- Origine
A l’exception des lipoxines dérivées de l’acide arachidonique, les médiateurs de la résolution de l’inflammation sont synthétisés à partir des acides gras polyinsaturés oméga 3. Ainsi, l’acide eicosapentaénoïque (EPA, C20 : 5) et l’acide docosahexaénoïque (DHA, C22 : 6) (tous deux des acides gras polyinsaturés oméga-3 libérés des membranes cellulaires par la phospholipase A2 ) sont convertis notamment suite à un processus enzymatique impliquant les cyclooxygénase (COX) et lipoxigénases(LOX) en médiateurs appelés résolvines (E, D), protectines ou marésines.
L’inflammation est une phénomène dynamique avec un changement de classe des oméga 6 au oméga 3 lors de la résolution (figure 3)
Figure 3: Utilisation des différents médiateurs lipidiques de l’inflammation en fonction du temps
c- En résumé
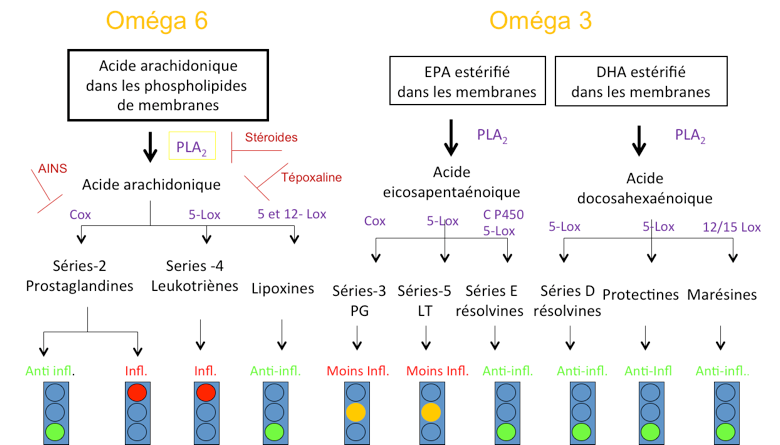
Le schéma classique de l’inflammation devient donc un peu plus compliqué( figure 4).
Figure 4: Récapitulatifs des médiateurs de l’inflammation et de leur précurseurs
Ce sont les même enzymes (phospholipase A2, cyclooxygénases et lipoxygénases) qui participent à la transformation des acides gras polyinsaturés en médiateurs pro-inflammatoires ou pro-résolution. Il ya aura donc une compétition entre les différents systèmes pour l’utilisation de ces enzymes présentes en quantité limité. De plus l’utilisation d’anti-inflammatoires stéroidiens ou non stéroidiens limite le déroulement de la résolution d’une part en éliminant les PGE2 et PGD2 et d’autre part en inhibant les enzymes responsables de la formation des médiateurs.
L’ EPA donne naissance à des résolvines pro-résolution mais aussi à des prostaglandines de série 3 et des leukotriènes de série 5 partiellement inflammatoires bien que moins actives que les séries 2 et 4 respectivement. Le DHA cependant ne donne naissance qu’ à des médiateurs pro-résolution avec aucun rôle inflammatoire.
3- Application pratique
3.1 la gestion de l’inflammation
Pour gérer l’inflammation et donc éviter la chronicité ou l’apparition de lésions il faut respecter 3 règles principales:
A– Eliminer la cause de l’inflammation
Le traitement peut être varié et doit être adapté à la cause: traitement anti-infectieux pour une infection bactérienne, utilisation d’un agent chondroprotecteur ( glucosamine, sulfate de chondroitine, acide hyaluronique) pour un problème articulaire chronique, ou retrait d’un épillet ou d’un point de suture pour un problème mécanique.
B- Utiliser les anti-inflammatoires mais avec précaution
Les anti-inflammatoires stéroidiens et non stéroidien ont toujours un rôle extrêmement important dans l’arsenal thérapeutique du clinicien. En raison de leur toxicité à long terme bien décrite et de leur potentiel à prévenir la résolution il faut essayer de diminuer la durée de traitement et la dose.
Il faut également noter que l’aspirine favorise la résolution en présence de Cox-2. Mais cette molécule a beaucoup d’effet indésirable chez l’animal. L’utilisation en phytothérapie de plantes comme la Reine des prés qui contient des salicosides transformés en acide salicylique ( et non pas acetylsalicylique) après absorption pourrait constituer une alternative intéressante pour avoir les effets bénéfiques sans les effets secondaires.
C– Promouvoir le résolution de l’inflammation
Pour le moment le seul moyen par lesquels les taux de résolvines, protectines et marésines pourraient être augmentés au site inflammatoire est l’administration de leurs précurseurs, les acides gras polyinsaturés oméga-3 DHA et EPA ( Kasuga et al 2008. L’utilisation de DHA et de EPA devra se faire en quantité suffisante dès le début de l’inflammation 15 mg/kg de DHA par jour) et prolonger quelques jours après disparition des signes cliniques.
La synergie avec d’autres traitement est réelle. De nombreuses études chez l’homme ont permis de montrer que la dose d’ anti-inflammatoires traditionnels peut être réduite de 33% en temps et en quantité avec l’utilisation de DHA et d’EPA par voie orale (Galarraga et al 2008, Goldberg and Katz 2007, Proudman et al 2008 ).
Les acides gras polyinsaturés ont aussi une activité anti-inflammatoire directe: antagonisme avec le métabolisme de l’acide arachidonique (compétition enzymatique,…); inhibition de la production de cytokines: TNF-α, IL-1β, IL-6; modifications des propriétés des membranes cellulaires; régulation du facteur de transcription NF-kB impliqué dans la réponse immunitaire; rôle anti-douleur ( Calder, 2006). Chez le chien, l’utilisation d’oméga-3 DHA et EPA s’est révélée bénéfique sur des chiens avec inflammation des articulations (Hansen et al 2008) ou de la peau avec dans ce cas, réduction de la quantité de stéroides employés (Saevik et al 2004) sans pouvoir préciser si l’effet est du à l’activité directe, la promotion de la résolution ou les deux.
3.2 Les sources des acides gras insaturés oméga -3
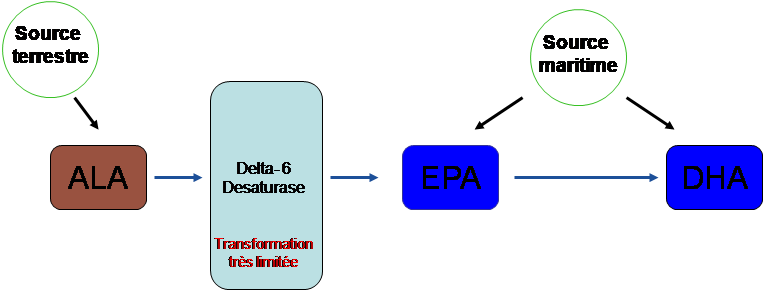
Les principaux acides gras polyinsaturés sont l’acide alpha linolénique (ALA), et le DHA et l’EPA.
L’ acide alpha linolénique est un acide gras essentiel car les mammifères ne peuvent pas le synthétiser. On le trouve dans les huiles de colza, de noix, tournesol ainsi que dans la graine de lin et le soja, l’origine étant toujours des plantes terrestres. L’ALA peut être converti en EPA et DHA par les mammifères mais la quantité de ALA effectivement transformé en EPA et DHA est très faible (0.2 et 0.05 respectivement chez l’homme) (figure 5)
Le DHA et l’EPA ne sont pas en théorie des acides gras essentiels car les animaux savent les synthétiser. Néanmoins en raison du faible rendement de transformation la seule façon de fournir ces acides gras aux animaux, et donc la possibilité de synthétiser les médiateurs de la résolution, est de les fournir directement sous la forme de compléments alimentaires. Le DHA e l’EPA se trouvent dans les poissons des mers froides (saumon, hareng, thon maquereau), les mammifères marins, les fruits de mer et certaines algues composant le phytoplancton. En fait seul le milieu marin peut fournir les apports en DHA et en EPA. L’EPA peut se transformer en DHA mais la transformation n’est pas optimale chez les carnivores. Les algues permettent d’obtenir des taux en DHA très élevés.
Figure 5 : Source d’ oméga 3
Dans la chaine alimentaire le phytoplancton est la première source d’oméga 3. Les poisons obtiennent leur oméga 3 en consommant des algues. Aujourd’hui les technologies nouvelles permettent de cultiver ces algues unicellulaires en milieu parfaitement contrôlé afin d’obtenir des concentrations importantes de DHA pur ( photo 1). L’utilisation de DHA provenant d’algues au lieu de poisson a des avantages écologiques majeurs: la culture d’une tonne d’algues absorbe 2.2 tonnes de CO2, réduisant notre empreinte carbone; comme il faut jusqu’à500kg de poisson pour produire 1 litre d’huile, la surpêche est évitée et la biodiversité marine préservée.
Photo 1: algues de phytoplancton
A l’inverse de l’huile de poisson qui peut contenir des métaux lourds et des pesticides à cause de la pollution des océans (Domingo et al 2007, Mahaffey et al 2008), l’ huile obtenue à partir d’algues en culture est pure et non toxique.
Le DHA et l’EPA sont très fragile et s’ oxyde facilement: ils doivent être présentés sous des formes galéniques les protégeant de l’air et de la lumière et il est impératif de les conserver au froid .
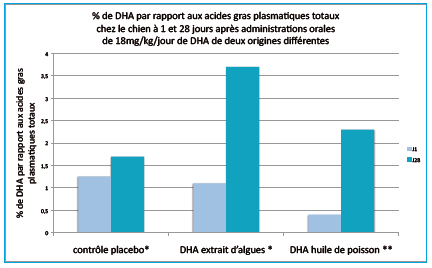
Chez le chien la biodisponibilité du DHA extrait d’algues est excellente. Des études conduites par Arcanatura ont montré des taux plasmatiques en DHA au moins aussi élevés que ceux rapportés dans la littérature pour des produits à base d’huile de poisson (figure 6)
Figure 6: Biodisponibilité du DHA après administration orale. * Données interne Arcanatura. ** Filburn and Griffin 2005.
CONCLUSIONS
Il est indispensable de promouvoir la résolution de l’inflammation pour mieux la gérer et éviter la chronicité. Les médiateurs de la résolution sont dérivés du DHA et de l’EPA qui sont deux types d’ oméga -3. Il est impératif d’assurer aux animaux un apport suffisant en DHA et EPA sous la forme de supplément nutritionnel en complément des traitement des pathologies inflammatoires chez les animaux. Des doses de 15 mg/kg/jour de DHA sont nécessaires pour observer un effet.. Les algues du phytoplancton constituent une alternative intéressantes aux huiles de poisson avec des avantages importants pour l’environnement.
References
Calder, P.C. 2006. N-3 polyunsaturated fatty acids, inflammation and inflammatory diseases. Am. J. Clin. Nutr. 83, 1505S-1519S.
Domingo, J.L., Bocia, A., Marti-Cid, R. and Llobet, J.M. 2007. Benefit and risk of fish consumption. Part II: RIBEPEIX a computer program to optimize the balance between the uptake of omega 3- fatty acids and chemical contaminants. Toxicology, 230, 227-233.
Filburn, C.R. and Griffin, D. 2005. Canine plasma and erythrocyte response to a docosahexaenoic acid-enriched supplement: characterization and potential benefits. Veterinary Therapeutics, 6, 29-42.
Galarraga, B., Ho, M., Youssef, H.M., McMahon, H., Hall, C., Ogston, S., Nuki, G., Belch, J.J.F. 2008. Cod liver oil (n-3 fatty acids) as a non steroidal anti-inflammatory sparing agent in rheumatoid arthritis, Rheumatology, 47, 665-669.
Goldberg, R.J. and Katz, J. 2007. A meta-analysis of the analgesic effect of omega 3 polyunsaturated fatty acid supplementation for inflammatory joint pain. Pain, 129, 210-223.Proudman, S.M., Cleland, L.G., James,M..J 2008. Dietary omega-3 fats for treatment of inflammatory joint disease: efficacy and utility. Rheum. Dis. Clin. N. Am. 34, 469-479.
Hansen, R.A., Harris, M.A., Pluhar, E., Motta, T., Brevard, S., Ogilvie, G.K., Fettman, M.J., Allen, K.G.D. 2008. Fish oil decreases matrix metalloproteinases in knee synovial of dogs with inflammatory joint disease. J. Nutr. Biochem. 19, 101-108
Kasuga, K., Yang, R., Porter, T.F., Agarwal, N., Petasis, N.A., Irimia, D., Toner, M., Serhan, C.N. 2008. Rapid appearance of resolving precursors in inflammatory exudates: novel mechanisms in resolution. J. Immunol. 181, 8677-8687.
Mahaffey, K.R., Clickner, R.P. and Jeffries, R.A. 2008. Methylmercury and omega 3- fatty acids: Co- occurrence of dietary sources with emphasis on fish and shellfish. Environmental Research, 107, 20-29.
Saevik, B.K., Bergvall, K., Holm, B.R., Siajonmaa-Koulumies, L.E., Hedhammar, A., Larsen, S., Kristensen, F. 2004. A randomized controlled study to evaluate the steroid sparing effect of essential fatty acid supplementation in the treatment of canine atopic dermatitis. Vet. Dermatol. 15, 137-145.
Serhan, C. N. 2008. Systems approach with inflammatory exudates uncovers novel anti-inflammatory and pro-solving mediators. Prostaglandins Leukotrienes and Essential Fatty Acids 79, 157-163.
Serhan, C. N., Yacoubian, S., Yang, R. 2008. Anti-inflammatory and prosolving lipid mediators. Annu. Rev. Pathol. Mech. Dis. 3, 279-312.